Nguyên tử khối là gì, bảng nguyên tử khối các nguyên tố hóa học là kiến thức cần thiết cho các bạn vừa nhập môn Hóa học. Trong bài viết này, mình sẽ chia sẻ cách học thuộc bảng nguyên tử khối dễ dàng cùng cách giải các bài tập liên quan. Hãy đọc tiếp bên dưới nhé!
Nguyên tử khối là gì?
Khái niệm về Nguyên tử khối
Nguyên tử khối là khối lượng trung bình của một nguyên tử trong một mẫu chất, so với đơn vị khối lượng chuẩn được gọi là “đơn vị khối nguyên tử” (Unified Atomic Mass Unit – u hay amu).
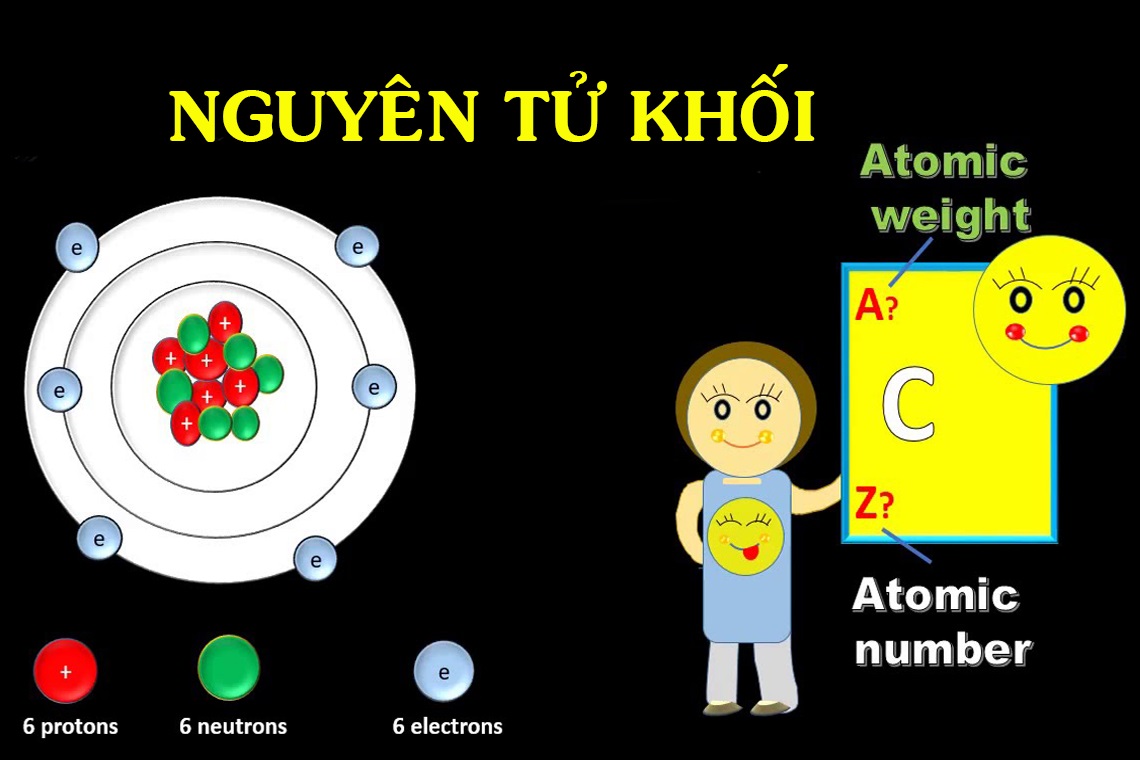
Đơn vị khối nguyên tử
– Đơn vị khối nguyên tử u hay amu được chọn dựa trên khối lượng của nguyên tử carbon-12 (^12C), được xác định là chính xác 1/12 khối lượng của một nguyên tử carbon-12.
– Đơn vị khối nguyên tử u tương đương với khoảng 1,66 x 10^(-27) kg.
Sự biến đổi của Nguyên tử khối
– Nguyên tử khối của một nguyên tố có thể thay đổi do sự tồn tại của các đồng vị (cùng số nguyên tử nhưng khác khối lượng nguyên tử).
Nguyên tử khối có phải số khối không?
Không, nguyên tử khối không phải là số khối. Nguyên tử khối là một giá trị số đại diện cho khối lượng trung bình của một nguyên tử trong một mẫu chất. Đơn vị thông thường được sử dụng cho nguyên tử khối là đơn vị khối nguyên tử (Unified Atomic Mass Unit – u hay amu).
Một số nguyên tử khối của các nguyên tố được biểu thị bằng số gần đúng, chẳng hạn như nguyên tử khối của oxi là khoảng 16, và nguyên tử khối của carbon là khoảng 12. Đây là giá trị gần đúng vì nguyên tử khối của mỗi đồng vị trong tự nhiên có thể khác nhau và có ảnh hưởng đến nguyên tử khối trung bình của nguyên tố.
Cách tính Nguyên tử khối trung bình của nguyên tố
Bước 1: Xác định khối lượng nguyên tử của từng đồng vị: Sử dụng bảng tuần hoàn các nguyên tố hóa học, tìm khối lượng nguyên tử của từng đồng vị.
Bước 2: Xác định tỷ lệ phần trăm mỗi đồng vị trong mẫu chất: Tỷ lệ phần trăm mỗi đồng vị được xác định dựa trên tần suất xuất hiện của chúng trong tự nhiên hoặc trong mẫu chất cụ thể.
Bước 3: Tính toán nguyên tử khối trung bình: Sử dụng tỷ lệ phần trăm mỗi đồng vị, nhân khối lượng nguyên tử của từng đồng vị với tỷ lệ tương ứng và cộng dồn lại.
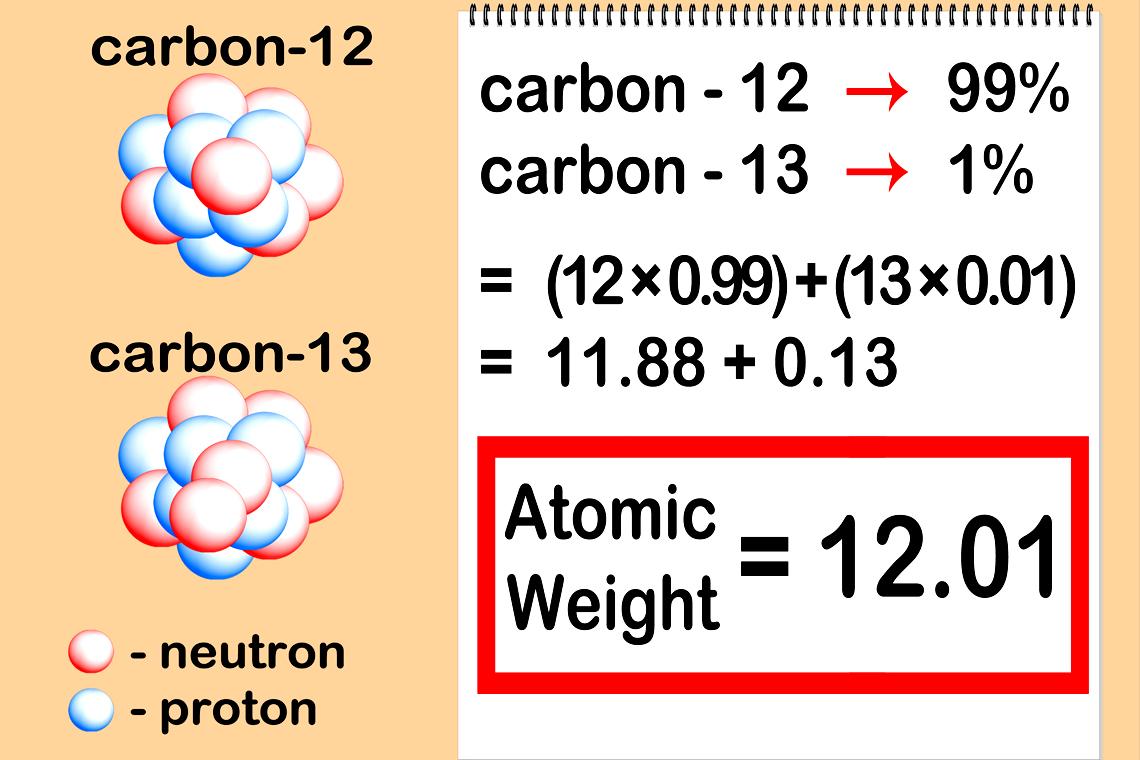
Cách tính nguyên tử khối trung bình của nguyên tố Cacbon
Để làm rõ cách tính nguyên tử khối của một nguyên tố, hãy xem ví dụ với nguyên tố oxy (O). Nguyên tử oxy có ba đồng vị phổ biến là Oxygen-16 (^16O), Oxygen-17 (^17O) và Oxygen-18 (^18O).
- Khối lượng nguyên tử của oxygen-16 là 16 u.
- Khối lượng nguyên tử của oxygen-17 là 17 u.
- Khối lượng nguyên tử của oxygen-18 là 18 u.
Tỷ lệ phần trăm mỗi đồng vị của oxy được xác định dựa trên tần suất xuất hiện trong tự nhiên. Chẳng hạn, trong tự nhiên, oxygen-16 chiếm khoảng 99,76%, oxygen-17 chiếm khoảng 0,04% và oxygen-18 chiếm khoảng 0,20%.
Sử dụng tỷ lệ phần trăm mỗi đồng vị và khối lượng nguyên tử tương ứng, tính toán nguyên tử khối trung bình của oxy.
Nguyên tử khối trung bình (OAVG) của oxy sẽ được tính theo công thức sau: OAVG = (%16O x 16 u) + (%17O x 17 u) + (%18O x 18 u)
Với ví dụ này, ta có thể tính toán nguyên tử khối trung bình của oxy như sau: OAVG = (99,76% x 16 u) + (0,04% x 17 u) + (0,20% x 18 u)
Sau khi tính toán, ta sẽ có giá trị nguyên tử khối trung bình của oxy (OAVG). Trong trường hợp của oxy, giá trị này là khoảng 15,999 u.
Ứng dụng của Nguyên tử khối
Xác định thành phần đồng vị trong một mẫu chất
Dựa trên nguyên tử khối, có thể tính toán tỷ lệ phần trăm mỗi đồng vị có mặt trong một mẫu chất.
Ví dụ: Xác định nguồn gốc và quá trình hình thành của các khoáng vật
Trong lĩnh vực địa chất, nguyên tử khối được sử dụng để xác định nguồn gốc và quá trình hình thành của các khoáng vật. Các khoáng vật có thể chứa các nguyên tố khác nhau và các đồng vị của những nguyên tố này có thể có tỷ lệ phần trăm khác nhau.
Ví dụ, xét trường hợp của khoáng vật calcit (CaCO3), một thành phần chính của đá vôi. Calcit có thể chứa các nguyên tử khối khác nhau của carbon (C) và oxy (O), như carbon-12, carbon-13, oxygen-16, oxygen-17 và oxygen-18.
Bằng cách xác định tỷ lệ phần trăm của các đồng vị này trong một mẫu calcit, chúng ta có thể phân biệt và xác định nguồn gốc của khoáng vật, cũng như quá trình hình thành của nó. Ví dụ, các tỷ lệ phần trăm đồng vị có thể cho thấy calcit được hình thành trong môi trường biển nước mặn hoặc nước ngọt, hoặc có thể cho thấy sự tác động của quá trình địa chất như nhiệt độ và áp suất.
Điều này cung cấp cho chúng ta thông tin quan trọng về lịch sử hình thành của các khoáng vật và có thể được sử dụng để nghiên cứu về địa chất, quá trình địa chất và tạo ra các ứng dụng trong lĩnh vực khai thác khoáng sản và nguồn nước ngầm, cũng như trong nghiên cứu địa chất lịch sử và biểu đồ thời gian địa chất.
Xác định khối lượng của một mẫu chất không biết
Bằng cách sử dụng nguyên tử khối trung bình, ta có thể tính toán khối lượng của một mẫu chất khi biết tỷ lệ phần trăm của các đồng vị có trong mẫu.
Ví dụ: Xác định khối lượng một hợp chất hữu cơ không biết
Giả sử bạn có một hợp chất hữu cơ không biết và bạn muốn xác định khối lượng của nó. Bạn biết rằng hợp chất này chứa carbon (C), hydrogen (H) và oxygen (O). Bạn thu thập một mẫu chất và tiến hành phân tích nguyên tử khối của các đồng vị carbon, hydrogen và oxygen có trong mẫu.
Sau đó, bạn xác định tỷ lệ phần trăm của mỗi đồng vị trong mẫu chất bằng các phương pháp phân tích, chẳng hạn như phổ hấp thụ ánh sáng hoặc phổ phát xạ. Bạn cũng biết các khối lượng nguyên tử của các đồng vị tương ứng.
Tiếp theo, bạn tính toán khối lượng trung bình của mẫu chất bằng cách nhân tỷ lệ phần trăm mỗi đồng vị với khối lượng nguyên tử tương ứng và cộng dồn lại. Kết quả sẽ cho bạn khối lượng trung bình của mẫu chất không biết.
Điều này rất hữu ích trong việc xác định khối lượng các hợp chất không biết hoặc trong việc xác định độ tinh khiết của một chất trong phân tích hóa học.
Bảng Nguyên tử khối các nguyên tố hóa học lớp 8
Bảng nguyên tử khối, còn được gọi là Bảng hệ thống nguyên tố hóa học, là một bảng được sắp xếp sắp xếp các nguyên tố hóa học theo thứ tự tăng dần của nguyên tử khối. Bảng này là công cụ quan trọng trong hóa học để xác định thông tin cơ bản về các nguyên tố, bao gồm nguyên tử khối, ký hiệu nguyên tố, tên nguyên tố, và các thông số khác.
| Số hiệu nguyên tử | Tên nguyên tố | Kí hiệu hóa học | Năm tìm ra | Nguyên tử khối |
| 1 | Hidro | H | 1766 | 1 |
| 2 | Heli | He | 1868 | 4 |
| 3 | Liti | Li | 1817 | 7 |
| 4 | Beri | Be | 1797 | 9 |
| 5 | Bo | B | 1808 | 11 |
| 6 | Cacbon | C | Thời tiền sử | 12 |
| 7 | Nito | N | 1772 | 14 |
| 8 | Oxi | O | 1771 | 16 |
| 9 | Flo | F | 1886 | 19 |
| 10 | Neon | Ne | 1898 | 20 |
| 11 | Natri | Na | 1807 | 23 |
| 12 | Magie | Mg | 1808 | 24 |
| 13 | Nhôm | Al | 1825 | 27 |
| 14 | Silic | Si | 1824 | 28 |
| 15 | Photpho | P | 1669 | 31 |
| 16 | Lưu huỳnh | S | Thời tiền sử | 32 |
| 17 | Clo | C | 1774 | 35.5 |
| 18 | Agon | Ar | 1894 | 40 |
| 19 | Kali | K | 1807 | 39 |
| 20 | Caxi | Ca | 1808 | 40 |
| 21 | Scandi | Sc | 1879 | 45 |
| 22 | Titan | Ti | 1791 | 48 |
| 23 | Vanadi | V | 1801 | 51 |
| 24 | Crom | Cr | 1797 | 52 |
| 25 | Mangan | Mn | 1774 | 55 |
| 26 | Sắt | Fe | Thời tiền sử | 56 |
| 27 | Coban | Co | 1737 | 59 |
| 28 | Niken | Ni | 1751 | 59 |
| 29 | Đồng | Cu | Thời tiền sử | 64 |
| 30 | Kẽm | Zn | Thế kỉ 17 | 65 |
| 31 | Gali | Ga | 1875 | 70 |
| 32 | Garmani | Ge | 1886 | 73 |
| 33 | Asen | As | Thời trung cổ | 75 |
| 34 | Seleni | Se | 1818 | 79 |
| 35 | Brom | Br | 1825 | 80 |
| 36 | Kripton | Kr | 1898 | 84 |
| 37 | Rubidi | Rb | 1861 | 85 |
| 38 | Stroni | Sr | 1808 | 88 |
| 39 | Ytri | Y | 1794 | 89 |
| 40 | Ziriconi | Zr | 1789 | 91 |
| 41 | Niobi | Nb | 1801 | 93 |
| 42 | Molipden | Mo | 1781 | 96 |
| 43 | Tecneti | Tc | 1937 | 98 |
| 44 | Ruteni | Ru | 1844 | 101 |
| 45 | Rhodi | Rh | 1803 | 103 |
| 46 | Paladi | Pd | 1803 | 106 |
| 47 | Bạc | Ag | Thời tiền sử | 108 |
| 48 | Cadimi | Cd | 1817 | 112 |
| 49 | Indi | In | 1863 | 115 |
| 50 | Thiếc | Sn | Thời tiền sử | 119 |
| 51 | Antimon (Stibi) | Sb | Thời trung cổ | 122 |
| 52 | Telu | Te | 1783 | 128 |
| 53 | Iot | I | 1811 | 127 |
| 54 | Xenon | Xe | 1895 | 131 |
| 55 | Xesi | Cs | 1860 | 133 |
| 56 | Bari | Ba | 1808 | 137 |
| 57 | Lantan | La | 1839 | 139 |
| 58 | Xeri | Ce | 1803 | 140 |
| 59 | Praseodymi | Pr | 1885 | 141 |
| 60 | Neodim | Nd | 1885 | 144 |
| 61 | Prometi | Pm | 1945 | 145 |
| 62 | Samari | Sm | 1879 | 150 |
| 63 | Europi | Eu | 1901 | 152 |
| 64 | Gadolini | Gd | 1986 | 157 |
| 65 | Tecbi | Tb | 1846 | 159 |
| 66 | Dysprosi | Dy | 1886 | 162.5 |
| 67 | Honni | Ho | 1897 | 165 |
| 68 | Erbi | Er | 1843 | 167 |
| 69 | Tuli | Tu | 1879 | 169 |
| 70 | Ytecbi | Yb | 1878 | 173 |
| 71 | Luteti | Lu | 1907 | 175 |
| 72 | Hafni | Hf | 1923 | 179 |
| 73 | Tantan | Ta | 1802 | 181 |
| 74 | Wolfram | W | 1783 | 184 |
| 75 | Rheni | Re | 1925 | 186 |
| 76 | Osmi | Os | 1804 | 190 |
| 77 | Iridi | Ir | 1804 | 192 |
| 78 | Platin | Pt | Thế kỉ 16 | 195 |
| 79 | Vàng | Au | Thời tiền sử | 197 |
| 80 | Thủy ngân | Hg | Thời tiền sử | 201 |
| 81 | Tali | Tl | 1861 | 204 |
| 82 | Chì | Pb | Thời tiền sử | 207 |
| 83 | Bismut | Bi | 1753 | 209 |
| 84 | Poloni | Po | 1898 | 209 |
| 85 | Astatin | At | 1940 | 210 |
| 86 | Radon | Rn | 1900 | 222 |
| 87 | Franci | Fr | 1939 | 223 |
| 88 | Radi | Ra | 1898 | 226 |
| 89 | Actini | Ac | 1899 | 227 |
| 90 | Thori | Th | 1828 | 232 |
| 91 | Protactini | Pa | 1917 | 231 |
| 92 | Urani | U | 1789 | 238 |
| 93 | Neptuni | Np | 1940 | 237 |
| 94 | Pluton | Pu | 1940 | 244 |
| 95 | Americi | Am | 1944 | 243 |
| 96 | Curi | Cm | 1944 | 247 |
| 97 | Berkeli | Bk | 1949 | 247 |
| 98 | Californi | Cf | 1950 | 251 |
| 99 | Einsteini | Es | 1952 | 252 |
| 100 | Fermi | Fm | 1953 | 257 |
| 101 | Medelevi | Md | 1955 | 258 |
| 102 | Nobeli | No | 1966 | 259 |
| 103 | Lawrenci | Lr | 1961 | 262 |
| 104 | Rutherfordi | Rf | 1964 | 267 |
| 105 | Dubni | Db | 1968 | 268 |
| 106 | Seaborgi | Sg | 1974 | 269 |
| 107 | Bohri | Bh | 1981 | 270 |
| 108 | Hassi | Hs | 1984 | 269 |
| 109 | Meineri | Mt | 1982 | 278 |
| 110 | Darmtadti | Ds | 1994 | 281 |
| 111 | Roentgeni | Rg | 1994 | 281 |
| 112 | Copernixi | Cn | 1996 | 285 |
| 113 | Nihoni | Nh | 2012 | 286 |
| 114 | Flerovi | Fl | 1998 | 289 |
| 115 | Moscovi | Mc | 2003 | 288 |
| 116 | Livermori | Lv | 2000 | 293 |
| 117 | Tennessine | Ts | 2010 | 294 |
| 118 | Oganesson | Og | 2006 | 294 |
Cách học thuộc bảng Nguyên tử khối
Bài ca hoặc bài thơ có thể giúp bạn học thuộc Bảng tuần tự nguyên tử khối một cách dễ dàng hơn. Dưới đây là một ví dụ về một bài thơ ngắn giúp bạn ghi nhớ nguyên tử khối của một số nguyên tố hóa học:
Nguyên tử khối ca
(Để học thuộc Bảng tuần tự nguyên tử khối)
Hydro mười một, Helium chỉ hai,
Carbon có mười hai, Nitơ mười bảy.
Oxi mười sáu, Sắt lên ba mươi,
Kali năm mươi, Canxi có bốn mươi.
Natri ba mươi, Lưu huỳnh hai chín,
Fluor mười chín, Phốt pho có mười sáu.
Nhôm ba mươi, Silicôn chín mươi,
Magnesi mười hai, Xenon trăm hai mươi.
Đây là một bài thơ nhỏ giúp bạn ghi nhớ một số nguyên tử khối cơ bản. Bạn có thể tạo ra các bài thơ tương tự hoặc áp dụng phương pháp này để tạo ra các bài thơ khác cho các nguyên tố khác trong Bảng tuần tự nguyên tử khối.
Bài tập về Nguyên tử khối các nguyên tố hóa học
Dưới đây là một số bài tập về nguyên tử khối các nguyên tố hóa học để bạn ôn tập và kiểm tra kiến thức của mình:
Bài tập 1: Xác định nguyên tử khối của các nguyên tố sau đây:
a) Carbon (C)
b) Nitơ (N)
c) Oxi (O)
d) Sắt (Fe)
e) Canxi (Ca)
Bài tập 2: Xác định nguyên tử khối trung bình của mẫu chất sau dựa trên tỷ lệ phần trăm các đồng vị:
a) Mẫu chất chứa carbon có 98% đồng vị ^12C (nguyên tử khối = 12) và 2% đồng vị ^13C (nguyên tử khối = 13).
b) Mẫu chất chứa oxi có 90% đồng vị ^16O (nguyên tử khối = 16) và 10% đồng vị ^18O (nguyên tử khối = 18).
Bài tập 3: Cho biết nguyên tử khối của các nguyên tố sau đây, hãy xác định số proton, số electron và số neutron của mỗi nguyên tử: a) Natri (Na) – nguyên tử khối = 23 b) Phốtpho (P) – nguyên tử khối = 31 c) Kali (K) – nguyên tử khối = 39
Bài tập 4: Xác định nguyên tử khối trung bình của một hợp chất không biết dựa trên tỷ lệ phần trăm của các nguyên tố trong hợp chất. Cho biết hợp chất chứa 60% carbon (C) và 40% oxi (O). Nguyên tử khối của ^12C là 12 và ^16O là 16.
Bài tập 5: Sắp xếp các nguyên tố sau đây theo thứ tự tăng dần của nguyên tử khối: Canxi (Ca), Hydro (H), Nitơ (N), Oxi (O), Sắt (Fe).
Giải bài tập về Nguyên tử khối
Dưới đây là cách giải các bài tập ở trên về nguyên tử khối các nguyên tố hóa học:
Bài tập 1:
a) Carbon (C) – Nguyên tử khối của carbon là 12.
b) Nitơ (N) – Nguyên tử khối của nitơ là 14.
c) Oxi (O) – Nguyên tử khối của oxi là 16.
d) Sắt (Fe) – Nguyên tử khối của sắt là 56.
e) Canxi (Ca) – Nguyên tử khối của canxi là 40.
Bài tập 2:
a) Để tính nguyên tử khối trung bình của mẫu chất chứa carbon, ta sử dụng tỷ lệ phần trăm của các đồng vị và nguyên tử khối tương ứng. Công thức tính là:
Nguyên tử khối trung bình = (Tỷ lệ phần trăm đồng vị 1 x nguyên tử khối đồng vị 1 + Tỷ lệ phần trăm đồng vị 2 x nguyên tử khối đồng vị 2 + …) / 100
Với carbon, ta có:
Nguyên tử khối trung bình = (98 x 12 + 2 x 13) / 100 = 12.01 (gần đúng).
b) Tương tự, để tính nguyên tử khối trung bình của mẫu chất chứa oxi, ta sử dụng tỷ lệ phần trăm của các đồng vị và nguyên tử khối tương ứng. Công thức tính là:
Nguyên tử khối trung bình = (Tỷ lệ phần trăm đồng vị 1 x nguyên tử khối đồng vị 1 + Tỷ lệ phần trăm đồng vị 2 x nguyên tử khối đồng vị 2 + …) / 100
Với oxi, ta có:
Nguyên tử khối trung bình = (90 x 16 + 10 x 18) / 100 = 16.2 (gần đúng).
Bài tập 3:
a) Natri (Na) – Nguyên tử khối của natri là 23. Số proton và số electron trong mỗi nguyên tử natri đều bằng 11. Để tính số neutron, ta sử dụng công thức:
Số neutron = Nguyên tử khối – Số proton
Số neutron = 23 – 11 = 12.
b) Phốtpho (P) – Nguyên tử khối của phốtpho là 31. Số proton và số electron trong mỗi nguyên tử phốtpho đều bằng 15. Để tính số neutron, ta sử dụng công thức:
Số neutron = Nguyên tử khối – Số proton
Số neutron = 31 – 15 = 16.
c) Kali (K) – Nguyên tử khối của kali là 39. Số proton và số electron trong mỗi nguyên tử kali đều bằng 19. Để tính số neutron, ta sử dụng công thức:
Số neutron = Nguyên tử khối – Số proton
Số neutron = 39 – 19 = 20.
Bài tập 4:
Để tính nguyên tử khối trung bình của một hợp chất không biết dựa trên tỷ lệ phần trăm của các nguyên tố, ta sử dụng công thức tương tự như bài tập 2. Ví dụ, với hợp chất chứa 60% carbon và 40% oxi, ta có:
Nguyên tử khối trung bình = (Tỷ lệ phần trăm carbon x nguyên tử khối carbon + Tỷ lệ phần trăm oxi x nguyên tử khối oxi) / 100
Nguyên tử khối trung bình = (60 x 12 + 40 x 16) / 100 = 14.4 (gần đúng).
Bài tập 5:
Để sắp xếp các nguyên tử theo thứ tự tăng dần của nguyên tử khối, ta chỉ cần xem nguyên tử khối của từng nguyên tử và sắp xếp chúng theo thứ tự từ nhỏ đến lớn. Ví dụ, sắp xếp từ nhỏ đến lớn là: Hydro (H), Nitơ (N), Oxi (O), Sắt (Fe), Canxi (Ca).